| Das eBook Angewandte Mikroelektronik wurde von Hans Lohninger zur Unterstützung verschiedener Lehrveranstaltungen geschrieben. Weitere Informationen finden sie hier. |

|

Home  Sensoren Sensoren  Chemische Sensoren Chemische Sensoren  Ionenselektive Elektroden Ionenselektive Elektroden |
||
| Siehe auch: Feldeffekttransistoren, ISFET, Metalloxid-Gassensoren, Lambda-Sonde | ||






|
||
Ionenselektive Elektroden
 Ionenselektive Elektroden sind Sensoren, die Konzentrationen von Ionen in wässrigen Lösung in einen Spannungspegel umwandeln, wobei sie eine hohe Selektivität für bestimmte Ionen aufweisen.
Ionenselektive Elektroden sind Sensoren, die Konzentrationen von Ionen in wässrigen Lösung in einen Spannungspegel umwandeln, wobei sie eine hohe Selektivität für bestimmte Ionen aufweisen.
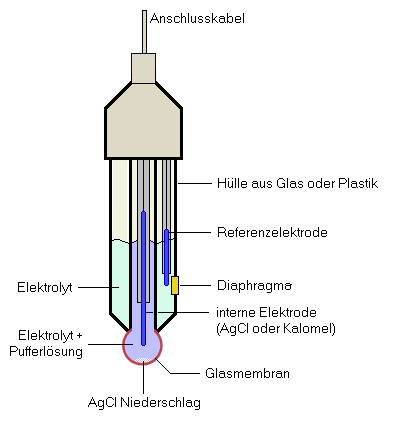
Eine der erfolgreichsten Elektroden ist die Glaselektrode, die selektiv H+ anzeigt. Diese Elektrode erzeugt eine Ausgangsspannung, die proportional zum Logarithmus der Konzentration der H+-Ionen in der Lösung ist (pH-Wert). Die Glaselektrode hat einen sehr hohen Innenwiderstand (1010 bis 1014 Ω), wodurch ein Verstärker mit einem sehr hohen Eingangswiderstand notwendig wird. Neben der H+-spezifischen Elektrode, sind eine große Zahl anderer selektiver Elektroden entwickelt worden (z.B. für Calcium, Fluorid, Natrium, Kalium, Nitrat, Sulphat oder Sulfid-Ionen). Diese Elektroden sind jedoch mehr oder weniger anfällig auf Störionen. Die Glaselektrode benötigt zur korrekten Funktion eine Referenzelektrode, die in modernen pH-Elektroden gleich mit eingebaut ist. Man spricht in diesem Fall von einer Einstabmesskette (siehe Abbildung rechts). Diese Einstabmesskette besteht aus zwei Rohren die ineinander geschoben sind. Das innere Rohr hat am Ende eine semipermeable Glasmembran die den Kontakt zur Messlösung herstellt. Im äußeren Rohr befindet sich die Referenzelektrode (meist eine Silberchlorid- oder eine Kalomelelektrode), die über ein Diaphragma mit der Messlösung verbunden ist. Die beiden Rohre sind mit einer Mischung aus Silber- und Kaliumchloridlösung (0.1 mol/l) als Elektrolyt gefüllt. Gemessen wird die Spannung zwischen der Referenzelektrode und der Glaselektrode. Diese Spannung ist abhängig von der Wasserstoffionenkonzentration (pH-Wert), da an der Glaselektrode je nach Acidität der Messlösung Wasserstoffionen eingelagert oder auch ausgelagert werden. Die Glasmembran besitzt innen und außen eine Quellschicht, in der Na+-Ionen gegen H+-Ionen ausgetauscht werden. Die äußere Seite der Glasmembran hat zur messenden Lösung Kontakt, die innere Seite zu einer gepufferten, also auf einen genauen pH-Wert eingestellten Lösung. Wird nun die Elektrode in eine Lösung gehalten, so werden sich im sauren Milieu H+-Ionen in die Quellschicht des Glases einlagern, oder es werden sich im basischen Milieu H+-Ionen aus der Quellschicht herausbewegen. Auf der Glasaußenseite wird dieser Vorgang durch die Messlösung kontrolliert, auf der Glasinnenseite durch die Pufferlösung mit fest eingestelltem pH-Wert. Es bildet sich also bei niedrigen pH-Werten außen eine Quellschicht mit grösseren H+-Anteil als innen, was zur Ausbildung eines elektrochemischen Potentials führt, das sich als Spannung zu einer Referenzelektrode messen lässt.
|
||
Home  Sensoren Sensoren  Chemische Sensoren Chemische Sensoren  Ionenselektive Elektroden Ionenselektive Elektroden |
||
Last Update: 2011-08-04

