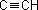| Teach/Me Instrumentelle Analytik ist ein bei Springer, Heidelberg, erschienenes CDROM-basiertes Lehrbuch zur instrumentellen chemischen Analytik. Weitere Informationen finden sie hier.... |

|

Home  Massenspektrometrie Massenspektrometrie  Prinzip der Massenspektrometrie Prinzip der Massenspektrometrie  Theorie der Fragmentierung Theorie der Fragmentierung  Elektronenstoßionisierung Elektronenstoßionisierung  Induktiver und Mesomerer Effekt Induktiver und Mesomerer Effekt |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siehe auch: Konkurrierende Zerfallsreaktionen | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||






|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Induktiver und mesomerer Effekt
Die Entstehung der Peaks eines Massenspektrums hängt im wesentlichen von drei Faktoren ab: (1) der Stärke der jeweiligen Bindung, (2) der induktive Effekt und (3) der mesomere Effekt. Bei genauerer Analyse eines Massenspektrums stellt man allerdings fest, dass viele Bindungen wenig oder gar nicht brechen, obwohl deren Bindungsenergie weit unter der Stoßenergie liegt. Für dieses Verhalten sind Faktoren verantwortlich, die sich aus der Elektronenverteilung im Molekül ableiten, und die dazu führen, dass positive Ionen stabilisiert werden. Induktiver Effekt: Falls die Nachbaratome eines positiv geladenen Atoms Elektronenspender sind können sie die positive Ladung teilweise neutralisieren und damit stabilisieren. Dieser Effekt wird "induktiver Effekt" genannt. Gruppen die Elektronen spenden, werden als +I-Gruppen bezeichnet, Gruppen die Elektronen abziehen als -I-Gruppen. +I-Gruppen stabilisieren ein positives Ion, -I-Gruppen destabilisieren es. Die am meisten verbreitete +I-Gruppe ist die Alkyl-Gruppe. Das erklärt auch die Tatsache dass das t-Butyl-Carbokation ausgesprochen stabil ist. Der induktive Effekt wirkt nur über maximal zwei Bindungen, ist als lokal sehr begrenzt.
Der mesomere Effekt tritt dann auf, wenn es im Molekül konjugierte Doppelbindungen gibt. Da die pi-Elektronen in konjugierten Systemen sehr leicht beweglich sind, können diese die positive Ladung über das gesamte konjugierte System verteilen ("delokalisieren"), was erheblich zur Stabilisierung eines positiven Ions beiträgt. Außerdem können Resonanzstrukturen (Strukturen, bei denen die Ladung zwischen den Atomen verschoben wird) zusätzlich zur Stabilisierung beitragen. Man nennt die Kombination von delokalisierter Ladung in konjugierten pi-Systemen und Resonanzstrukturen, den "mesomeren Effekt". Analog zum induktiven Effekt werden die Gruppen als +M- und -M-Gruppen bezeichnet. Eine +M-Gruppe stabilisiert eine positive Ladung, eine -M-Gruppe destabilisiert sie.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Home  Massenspektrometrie Massenspektrometrie  Prinzip der Massenspektrometrie Prinzip der Massenspektrometrie  Theorie der Fragmentierung Theorie der Fragmentierung  Elektronenstoßionisierung Elektronenstoßionisierung  Induktiver und Mesomerer Effekt Induktiver und Mesomerer Effekt |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Last Update: 2010-12-14