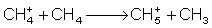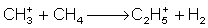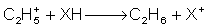| Teach/Me Instrumentelle Analytik ist ein bei Springer, Heidelberg, erschienenes CDROM-basiertes Lehrbuch zur instrumentellen chemischen Analytik. Weitere Informationen finden sie hier.... |

|

Home  Massenspektrometrie Massenspektrometrie  Aufbau eines Massenspektrometers Aufbau eines Massenspektrometers  Ionenquelle Ionenquelle  Chemische Ionisation Chemische Ionisation |
||||||||
| Siehe auch: Negative chemische Ionisation (NCI), Reaktantgase für die chemische Ionisation, Elektronenstoßionisation, Atmosphärendruck-Ionisation | ||||||||






|
||||||||
Chemische Ionisation
Das Reaktantgas wird bei einem Druck von etwa 1 Torr in der modifizierten EI-Ionisationskammer ionisiert (was einen Überschuss von 1:106 zur Probe bedeutet). Im folgenden seinen die Vorgänge bei der CI anhand von Methan beispielhaft erläutert: Ionisationsreaktionen des Methan:
Ionisation der Probe:
Charakteristika der chemischen Ionisation:
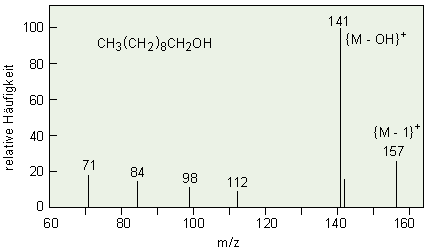
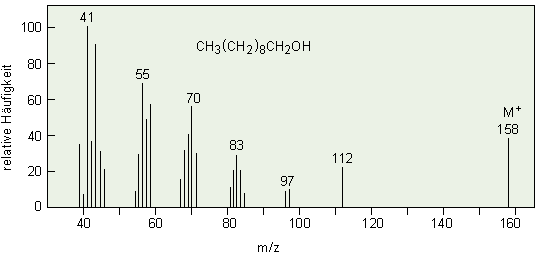
Vergleich der Massenspektren von
1-Decanol:
b) 70 eV-Elektronenstoß-Ionisation
Literatur: Harrison, A.G. "Chemical Ionization Mass Spectrometry", CRC Press, Boca Raton, 2nd edition, 1992.
|
||||||||
Home  Massenspektrometrie Massenspektrometrie  Aufbau eines Massenspektrometers Aufbau eines Massenspektrometers  Ionenquelle Ionenquelle  Chemische Ionisation Chemische Ionisation |
||||||||
Last Update: 2010-12-14